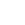18A.04
过去的版本: 有效期至 2020年09月30日
查看其它版本请点击右侧的版本索引标签。
除《上市规则》附录一A所载的资料外,生物科技公司并须在上市文件中披露下列各项:
| (1) | 战略目标; | ||||||||||||||||||||
| (2) |
各核心产品的详情,包括:
|
||||||||||||||||||||
| (3) | 核心产品相关监管批准(如有)生效日期以后并无出现任何意外或不利的重大变动的声明;若有任何重大变动,必须在显眼位置披露; | ||||||||||||||||||||
| (4) | 描述申请人拥有的获批准产品(如有)、未届满的专利保护期间以及现有及预期的市场竞争者的详情; | ||||||||||||||||||||
| (5) |
生物科技公司研发经验的详情,包括:
|
||||||||||||||||||||
| (6) | 生物科技公司董事及高级管理层在开发、制造以及商业化发展生物科技产品方面的相关经验; | ||||||||||||||||||||
| (7) | 申请人与其主要管理人员及技术人员之间订立的任何服务协议的主要条款; | ||||||||||||||||||||
| (8) | 申请人为留聘主要管理人员或技术人员而设的措施(例如奖励安排及/或不竞争条款)(如有),以及针对主要管理人员或技术人员离职而设的保障措施及安排; | ||||||||||||||||||||
| (9) | 说明任何可能会影响任何核心产品研发的法律申索或诉讼; | ||||||||||||||||||||
| (10) |
披露特定风险、一般风险及依赖因素,包括:
|
||||||||||||||||||||
| (11) |
若下列各项对公司业务营运相关并有重大影响,生物科技公司亦须提供以下资料:
|
||||||||||||||||||||
| (12) |
与核心产品有关的现金经营成本的估算,其中包括开发核心产品所产生的研发及临床试验成本,以及下列各项的相关成本:
|
||||||||||||||||||||
| (13) | 申请人有否接受专家技术评估及(如适用)在上市文件内载列该评估。 |